目次
本記事では、肺炎球菌ワクチンであるプレべナ-20に関する調査の内容についてまとめたものです。
※本記事は筆者が独自に調査した内容に基づき見解を記載するものであり、ワクチンによる効果の良否について論じるものではありません。
本記事の内容は個人的見解も含まれますので、内容の信憑性については個々で判断してください。
また、本記事の参照によるいかなる被害についても、本サイト管理人は一切責任を持ちません。
プレベナー20について
プレベナー20®は、沈降13価肺炎球菌結合型ワクチン(プレベナー13®)に含まれる13の血清型に加え、8、10A、11A、12F、15B、22F及び33Fが含まれる沈降20価肺炎球菌結合型ワクチンです。
https://www.pfizerpro.jp/medicine/prevenar20
本剤は、13価肺炎球菌結合型ワクチン「プレベナー13®」に7種の血清型を加えることにより、さらに広範な血清型による侵襲性肺炎球菌感染症を予防することが期待されます。小児における侵襲性肺炎球菌感染症は依然として少なくなく、本剤に追加した7種血清型の肺炎球菌に起因する割合が高いとされています
https://www.pfizer.co.jp/pfizer/company/press/2024/2024-03-26-01
沈降20価肺炎球菌結合型ワクチン「プレベナー20®水性懸濁注」新発売のお知らせ
https://www.pfizerpro.jp/medicine/prevenar20
(2024年8月吉日 ファイザー株式会社)
プレベナー20®は、沈降13価肺炎球菌結合型ワクチン(プレベナー13®)に含まれる13の血清型に加え、8、10A、11A、12F、15B、22F及び33Fが含まれる沈降20価肺炎球菌結合型ワクチンです。
尚、小児につきましては、プレベナー20®は10月1日より定期接種が開始となり、小児肺炎球菌ワクチンの定期接種はプレベナー20®が基本となります。
弊社では、プレベナー13®の発売以来、日本市場へ安定供給してきた供給体制の経験を、プレベナー20®でも継承していきたいと考えております。
発売後はプレベナー13®は、プレベナー20®に切り換えになります。
プレベナー20は2024年8月に新発売のプレスリリースが出されている。
小児は2024年10月1日より定期接種が開始。
血清型について
肺炎球菌ワクチンには、カバーする肺炎球菌の型が異なる複数の種類があります。
・PCV20(20価結合型肺炎球菌ワクチン)
https://tamatani-minoh-senba.com/blog/20241005_pediatric_pneumococcal_conjugate_vaccine/
・2024年10月からはじまったワクチン
・カバーする型:PCV15の15種 + 8, 10A, 11A, 12F, 15Bの合計20価
・特徴:現在最も多くの型をカバーする小児肺炎球菌ワクチン
プリベナー20は、20価にカバーする肺炎球菌の型が増えたワクチンだということが分かった。
(従来のものは13、その前は7、といった形で型が少なかった。)
臨床試験について
国内第Ⅲ相試験:プレベナー13に対するプレベナー20の非劣性試験
引用元:https://www.pfizerpro.jp/medicine/prevenar20-pediatric/efficacy-and-safety/clinical-trial-b7471016
安全性部分のみフォーカスして引用します。
凡例:
PCV20 SC:プレベナー20皮下投与
PCV20 IM:プレベナー20筋肉内投与
PCV13 SC:プレベナー13皮下投与
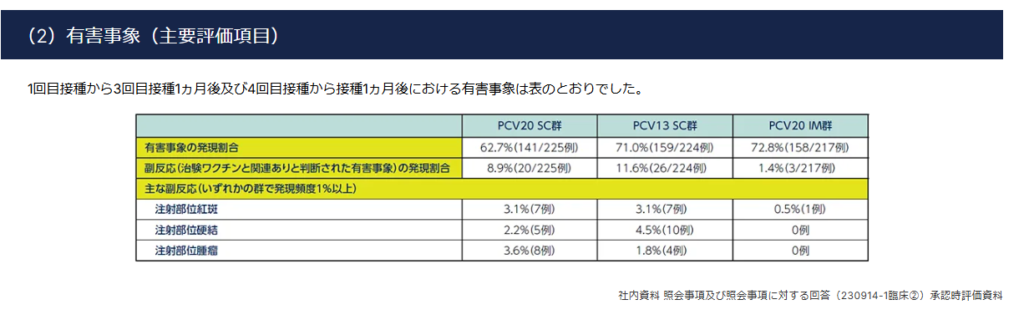
※AIによる説明
・注射部位紅斑とは、注射を行った部位が赤くなる現象を指します。
・注射部位硬結とは、注射を行った部位が硬くなる現象を指します。
・注射部位硬結とは、注射を行った部位が硬くなる現象を指します。
副反応は3%前後、発生していることが読み取れる。
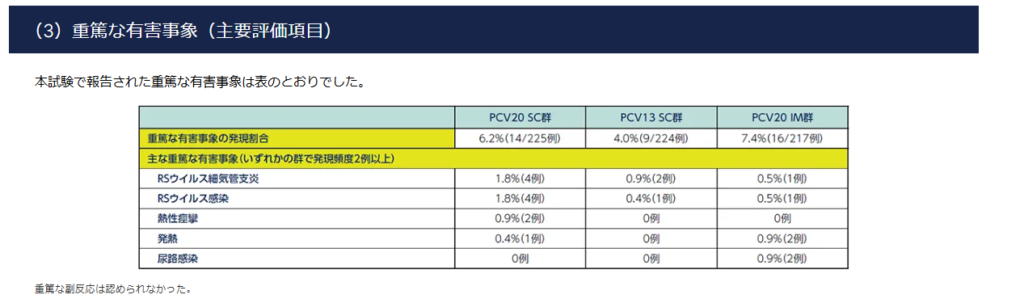
PCV20 SC・IM群共に、6~7%の有害事象が発生している。
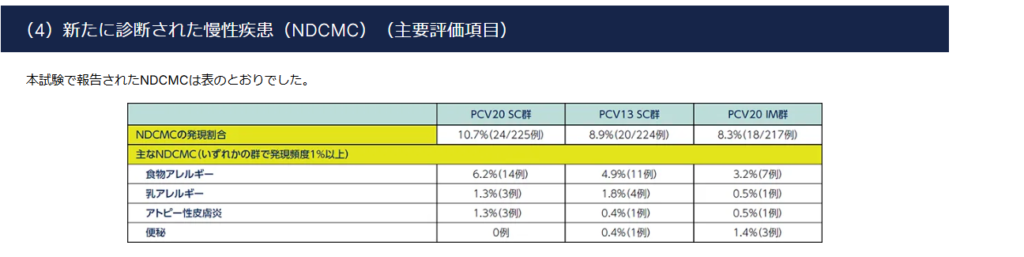
PCV20 SC・IM群共に、8~10%の慢性疾患が発生している。
アレルギー反応などが主。
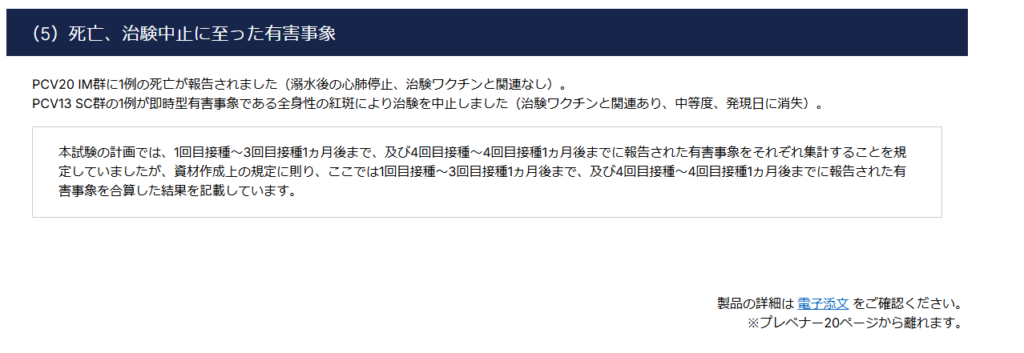
PCV20 IM群で1例の死亡例が報告あり。
報告内容によれば治療ワクチンとは関連がないとのことだが、詳細は不明。
独立行政法人医薬品医療機器総合機構 審査報告書
P.37から引用。
また、生後 15 カ月以上 18 歳未満の健康小児を対象とした海外第Ⅲ相試験
https://www.pmda.go.jp/drugs/2024/P20240829003/672212000_30600AMX00115_A100_2.pdf
(1014 試験)において、本剤の免疫原性及び安全性が確認でき、2~6 カ月齢の健康小児を対象とした国内第Ⅲ相試験(1016 試験)において、用法(接種回数)が異なるものの皮下及び筋肉内接種時の良好な免疫応答と安全性プロファイルが得られた(令和 6 年 2 月 19 日付け、プレベナー20 水性懸濁注審査報告書)。
安全性プロファイルって何よ?さらに審査報告書を読み取る必要がありそうだ。↓
プレベナー20 水性懸濁注審査報告書
同報告書から安全性部分のみを引用。
7.R.2.1 本剤の安全性プロファイルについて
https://www.pmda.go.jp/drugs/2024/P20240327001/672212000_30600AMX00115_A100_2.pdf
申請者は、本剤の安全性について以下のように説明している。
日本人小児を対象とした国内第Ⅲ相試験(1016 試験)の結果に基づき、PCV13(皮下接種)と比較することにより、本剤(筋肉内及び皮下接種)の安全性を評価した。また、国内第Ⅲ相試験(1016 試験)と試験デザイン(接種経路、接種スケジュール、同時接種ワクチン等)が異なるものの、試験間で試験デザインが類似する外国人小児を対象とした 3 つの海外臨床試験(1003 試験、1011 試験及び 1013 試験)の併合解析 21)の結果に基づき PCV13(筋肉内接種)と比較することにより、本剤(筋肉内接種)の安全性を評価した。さらに、外国人小児を対象とした海外第Ⅲ相試験(1014 試験)の結果に基づき、本剤(筋肉内接種)の安全性を評価した。
日本国内での試験で安全性を評価。
国内とは試験概要が違うけど、類似する外国人小児を対象とした3つの海外試験の結果から、安全性を評価したらしい。
局所反応の発現割合は、本剤 SC 群と PCV13 SC 群で同程度であり、ほとんどが軽度又は中等度であった。
局所反応の発現日の中央値は 1~2 日目で、持続期間の中央値は 1~5 日間であった。全身反応の発現割合も本剤 SC 群と PCV13 SC 群では同程度であり、いずれの群でも全身反応の中では傾眠状態及び易刺激性の報告が多く、ほとんどが軽度又は中等度であった。
発熱の発現割合は本剤 SC 群と PCV13SC 群で同程度であったが、両群ともに 4 回目接種後が最も高かった。40℃を超える発熱はほとんど認められず、解熱鎮痛剤の使用頻度も両群で同程度であった。
全身反応の発現日の中央値は 1~3 日目で、持続期間の中央値は 1~2 日間であった。また、本剤 IM 群の局所反応は、本剤 SC 群及び PCV13 SC 群と比較して発現割合が低く、特に注射部位発赤及び腫脹で低かった。全身反応の発現割合や発現状況、解熱鎮痛剤の使用頻度は、同程度であった。
有害事象は、本剤 SC 群、本剤 IM 群及び PCV13 SC 群のいずれでも小児によくみられる上咽頭炎が最も多く報告され(表 15)、ほとんどの有害事象は治験薬との因果関係が否定された。死亡例は本剤 IM群で 1 例認められ、死因は溺水による心肺停止とされ 9)、治験薬との因果関係は否定された。
重篤な有害事象の発現割合は各群で同程度であり、最も多く報告された SOC は「感染症および寄生虫症」であり、主に RS ウイルス感染と関連していた(表 16)。
重篤な有害事象はいずれも治験薬との因果関係が否定された。治験中止に至った有害事象は、PCV13 SC 群 1 例(即時型の全身性紅斑)に認められ、副反応とされたものの、回復した。
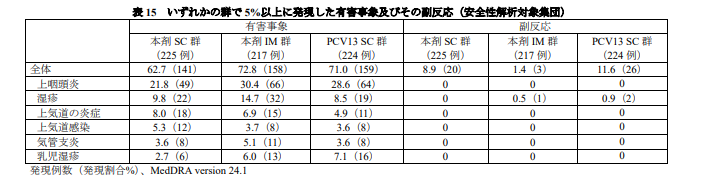
有害事象はSC,IMで60%~70%程度発生している。
副反応は10%前後発生。

重篤な有害事象は上記の通り発生しているが、「重篤な有害事象はいずれも治験薬との因果関係が否定」されている。
7.R.2.2 注目すべき有害事象について
7.R.2.2.1 痙攣発作(熱性痙攣含む)について
申請者は、痙攣発作(熱性痙攣含む)の発現状況について、以下のように説明している。
国内第Ⅲ相試験(1016 試験)では、本剤接種後に痙攣発作が非重篤なものを含め 5 例認められ、いずれも熱性痙攣であった。そのうち 2 例(本剤 SC 群 1 例及び本剤 IM 群 1 例)は 4 回目接種後 2 日以内に
発現し、本剤 IM 群の 1 例は副反応と判断されたが、同時接種ワクチンによる影響も否定できないと判断された。
その他の 3 例は本剤 SC 群で報告され、3 回目接種 79 日後及び 116 日後、4 回目接種 10 日後に発現した。
3 回目接種後に報告された 2 例は重篤例であったが、3 例とも本剤との因果関係は否定され
た。
海外 3 試験の併合解析では、痙攣発作の発現割合は低く(本剤 IM 群 0.5%(12/2,232 例)及び PCV13IM 群 0.5%(9/1,720 例)、いずれも治験薬との因果関係は否定された。なお、そのうち熱性痙攣は、本剤 IM 群の 6 例(0.3%)及び PCV13 IM 群の 2 例(0.1%)で報告された。
以上の臨床試験成績に加え、PCV13 の国内市販後において痙攣(熱性痙攣を含む)が報告されていることを踏まえると、本剤接種後に痙攣(熱性痙攣を含む)を発現する可能性が考えられ、本事象の発現後に速やかな処置がなされない場合、重篤な転帰をたどる可能性があるため、PCV13 と同様に、本剤の添付文書等において痙攣について注意喚起を行うとともに、製造販売後に引き続き情報収集を行う。
国内の試験で、本剤接種後に痙攣発作が非重篤なものを含め 5 例認められ、いずれも熱性痙攣であったとのこと。
5例のうち、本薬剤の副反応と認められたのは1件のみ。
その他は、本薬剤との因果関係は否定されている。(その根拠は?不明。)
海外の結果は1%以下と低く、因果関係は否定されている。(これも詳細は不明)
痙攣は起こる可能性あるから、発売後も注意喚起をしようねとのこと。
小児期においては一定の頻度で熱性痙攣が発現することが報告されており、国内第Ⅲ相試験(1016 試験)及び海外 3 試験の併合解析における熱性痙攣の発現頻度は、通常の有病率(国内 3.4~9.3%、米国2~5%)に比べて高くないと考える(一般社団法人日本小児神経学会「熱性けいれん(熱性発作)診療ガイドライン 2023」令和 5 年 1 月 1 日)。
しかしながら、国内第Ⅲ相試験(1016 試験)において本剤群でのみ熱性痙攣が 5 例に認められ、本剤との因果関係が否定されない報告もあったことを踏まえると、
本剤接種後の痙攣(熱性痙攣を含む)の発現には注意が必要であり、異常が認められた場合には速やかに医師の診察を受けるよう、本剤の添付文書において注意喚起する必要があると考える。また、製造販売後に引き続き情報収集・評価を行うことが適切と考える。
子供は痙攣が一定程度起こるもので、日本小児神経学会のガイドラインによる有病率と照らし合わせれば、今回の試験で発生した痙攣は低い発症率だと思われるよ。(因果関係は否定されているけどもね)
でも一応、添付文書では注意喚起をしておこう。あと、販売後も情報収集と評価は続けていきましょうね。
市販直後調査 第 2 回中間報告
引用元:https://www.pfizermedicalinformation.jp/system/files/resource/EPV68O036A_0.pdf
市販直後の副反応等の報告件数について確認ができる。
集計期間は2024年8月~12月
4か月で300件の副反応報告があった様子。
本中間報告対象期間中(2024 年 8 ⽉ 30 ⽇〜2024 年 12 ⽉ 29 ⽇)に報告された副反応等は、216 例305 件でした。
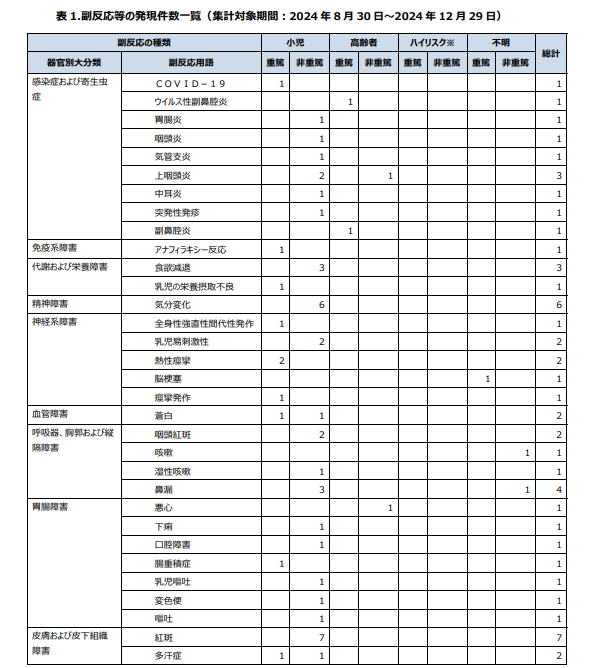
副反応報告の表を抜粋。
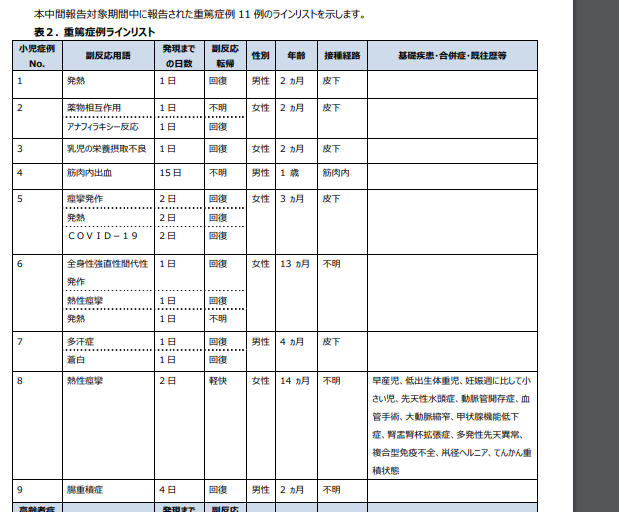
生後2か月~14か月の重篤症例。9件ある。
痙攣は3件起きている様子。 (No.5,6,8)
今回の調査はいったんここまでとする。
今回は安全性部分のみに着目して、いくつかの臨床試験、結果報告書を一部分だが読み取った。
結果だけみると、重大な副反応や重篤症状の発生は低いらしい。が、発生はしている。
ほとんど因果関係は否定されているが、否定された根拠まではさすがに記載はなかった。
直近2024年の販売直後の副反応等の報告件数が、4か月で300件ほどだった。
全体の摂取母数が分からないので統計的に多いのか少ないのかは判断できないが、300件は確実に副反応が発生しているということに間違いはない。
ワクチン接種の有効性については、「IgG抗体濃度」に関するデータの記載が多くあったが、
今回は時間の関係もあり、詳細に読み解くには至らなかった。
抗体濃度が高くなるのはわかった。過去の13のデータでは肺炎球菌の予防に効果があったとの記載も見受けられた。(そりゃそう書くだろうが・・・)


